腫瘤難治,怎么辦��?
眾所周知����,腫瘤越來越成為人類健康的重大威脅。腫瘤細(xì)胞作為變異的自身細(xì)胞較難被機(jī)體清除外��,多年的研究開發(fā)出來一些針對特定腫瘤的治療方式還不能通用于其他類型的腫瘤�����,這就造成了許多治療手段的治療局限性,那么�����,有不有那么一種治療手段����,也許,能夠?qū)λ械哪[瘤都有效呢�?
或許真的有。
在《Journal of Biological Chemistry》(JBC)上刊登的一篇論文就提出了一個新的腫瘤治療思路��,截斷腫瘤細(xì)胞的能量來源���,來個釜底抽薪����,餓死它們���!
或許你會嗤之以鼻����,餓死它們,正常細(xì)胞不也活不了了����。這種方式不就和普通的放療化療一樣,沒有較好選擇性����,只知道不分青紅皂白的殺傷所有細(xì)胞嗎?治療效果能好到哪兒去���?
別慌,聽我慢慢道來��。
怎么餓死它們�����?
我們知道��,正常的人體細(xì)胞的能量供應(yīng)極大的依賴于三羧酸循環(huán)(TCA)����,而三羧酸循環(huán)需要循環(huán)的中間產(chǎn)物保持一定的濃度才能正常進(jìn)行,否則����,這個過程就會受到嚴(yán)重影響���,進(jìn)而影響到細(xì)胞獲取能量與產(chǎn)生足夠的代謝需要的各種小分子前體。
了解到這一點��,我們就會明白一些快速生長的細(xì)胞���,比如腫瘤細(xì)胞�����,因為相對而言極為缺少這些中間產(chǎn)物��,三羧酸循環(huán)顯然不能為它們提供足夠的能量來源����。怎么辦呢�����?狡猾的腫瘤進(jìn)化(發(fā)展)出一種新的能量利用途徑——谷氨酰胺降解�����,這個線性變化版本的TCA通過直接利用谷氨酰胺分解來產(chǎn)生大量能量與代謝需要的小分子前體從而滿足腫瘤細(xì)胞快速生長的需要。
好像可以歡飲鼓舞了����,哈,阻斷了這個途徑����,腫瘤你還不得像無根之木一樣啊。應(yīng)該是這樣����,而且,如果我們能從源頭上阻斷這個途徑——阻止腫瘤細(xì)胞攝取谷氨酰胺�,是不是應(yīng)該是最好的治療手段呢?
從這個思路出發(fā)���,JBC上的這篇論文就設(shè)計了他們的實驗。腫瘤攝取谷氨酰胺需要的是相應(yīng)的管氨酰胺轉(zhuǎn)運體���,而現(xiàn)在鑒別出來的這些轉(zhuǎn)運體包括SNAT1�,SNAT2��,SNAT4��,LAT1,ASCT2等�,一般認(rèn)為ASCT2和LAT1是對腫瘤細(xì)胞來說最重要的。因此�����,這個研究也主要針對阻斷這兩種轉(zhuǎn)運體來設(shè)計���。
接觸腫瘤學(xué)較多的科學(xué)家可能會替論文的研究者擔(dān)憂了��,這兩種轉(zhuǎn)運體在腫瘤細(xì)胞中的高表達(dá)已經(jīng)被證實超過10年了�,前人已經(jīng)做了不少研究�,認(rèn)為ASCT2對于谷氨酰胺的凈攝取更為重要,因此阻斷它十分必要����,但是現(xiàn)存的它的阻斷劑,benzylserine和γ-谷氨酰-對硝基苯胺鹽酸鹽的特異性以及效果都不好��,根本不可能起到治療作用�。
怎么辦呢?研究人員Angelika Bröer等采用RNAi技術(shù)來沉默ASCT2的表達(dá)�,卻發(fā)現(xiàn)它也只能使谷氨酰胺的攝取減少50%,隨后��,他們又用CRISPR/Cas-9技術(shù)來制作ASCT2 (-/-)系腫瘤細(xì)胞,發(fā)現(xiàn)也只能能使谷氨酰胺的攝取減少60%�����。
為什么效果不好呢����?研究者觀察到,在這種缺少ASCT2的細(xì)胞中���,他們SNAT1的運輸活性��、蛋白水平等都是提升的����。同時�����,這種細(xì)胞系攝取谷氨酰胺的水平雖然下降了��,但是細(xì)胞生長活性以及谷氨酰胺的凈攝取實際上相對母系細(xì)胞是大致相同的��。另外�����,[13C5]谷氨酰胺代謝標(biāo)記實驗也證明����,在母系以及ASCT2 (-/-)系細(xì)胞中,放射性的谷氨酰胺降解產(chǎn)物大量存在��。
這些實驗結(jié)果都提示���,ASCT2對谷氨酰胺的凈攝取作用不大���,抑制了ASCT2的活性,SNAT1的活性會后繼升高�����,一定程度的補償它的作用�。另外,SNAT1在谷氨酰胺的凈攝取中具有重要意義�。
還有其他轉(zhuǎn)運體參與嗎?有的���,ASCT2的表達(dá)降低能夠使 tRNA卸載反應(yīng)增多�,這個反應(yīng)又能使SNAT2表達(dá)增加,從而彌補ASCT2的作用�����。而且��,在上述的ASCT2 (-/-)中����,單獨沉默SNAT1對腫瘤細(xì)胞生長活性影響不大。(圖1)顯示可能SNAT2有補償作用��。
因此���,研究者又在這種細(xì)胞中沉默GCN2的表達(dá)(降低上述的tRNA卸載反應(yīng)從而降低SNAT2的水平)�����,果然���,腫瘤細(xì)胞的生長活性從K=0.035降至0.0018。這個結(jié)果已經(jīng)足夠令人驚喜��,還有沒有更方便的手段呢����?
研究者考慮到SNAT1的重大作用,遂將SNAT1和SNAT2分別沉默(前者采用RNAi�,后者采用抑制劑MeAIB),發(fā)現(xiàn)竟然能將母系腫瘤細(xì)胞的活性從K=0.05劇降至0.003��。(圖1)
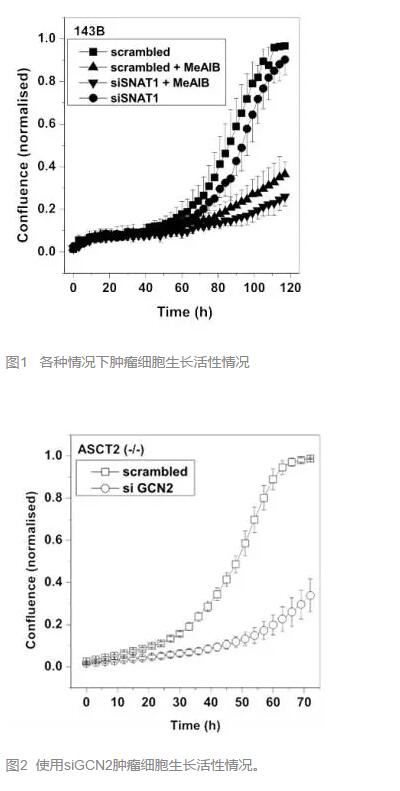
喜大普奔�����?
論文的結(jié)果顯示�����,他們的研究證實了這三種轉(zhuǎn)運體在腫瘤生長中的重要作用�,如果采用恰當(dāng)?shù)氖侄巫钄噙@些轉(zhuǎn)運體,將可以極有效的抑制腫瘤生長���,從而達(dá)到治療作用����。
當(dāng)然�����,前景是美妙的,道路是曲折的����。這個研究也并不意味著我們就可以直接采用這種方式完全控制腫瘤。首先����,此研究只選取了兩種腫瘤細(xì)胞,宮頸癌HeLa細(xì)胞和骨肉瘤143B細(xì)胞���,其他腫瘤細(xì)胞哪些轉(zhuǎn)運體更重要我們還不能貿(mào)然下結(jié)論��。其次��,細(xì)胞實驗的結(jié)果還需要進(jìn)一步的動物實驗和臨床試驗來驗證��。
但是�����,這項研究終歸為我們對抗腫瘤提供了一項新的可行性思路���,有望在將來開發(fā)出更安全�����、應(yīng)用范圍更廣泛、效果更優(yōu)異的腫瘤治療手段�,幫助人類有效的對抗這個不久之前談之色變的惡性殺手。
(本文為“醫(yī)學(xué)界腫瘤頻道”原創(chuàng)文章�,轉(zhuǎn)載需授權(quán)并注明作者和來源。)
參考文獻(xiàn):
Bröer A, Rahimi F, Bröer S. Deletion of amino acid transporter ASCT2 (SLC1A5) reveals an essential role for transporters SNAT1 (SLC38A1) and SNAT2 (SLC38A2) to sustain glutaminolysis in cancer cells. JBC Papers in Press. Published on April 26, 2016 as Manuscript M115.700534.





